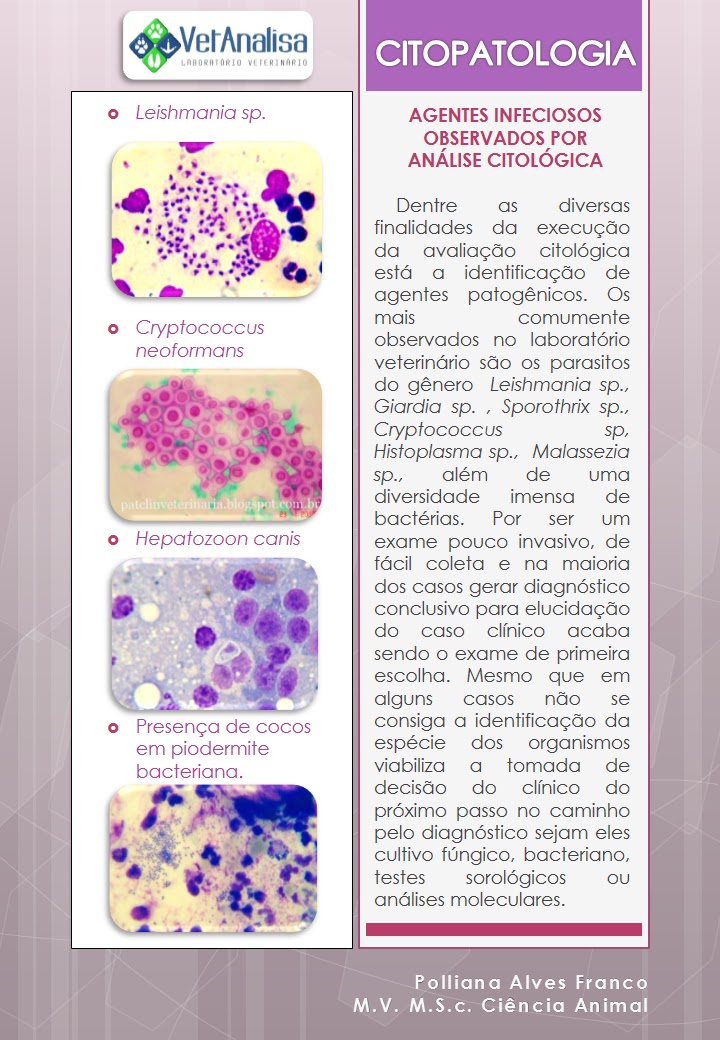
ANEMIA MICROCÍTICAS EM ANIMAIS DOMÉSTICOS
MICROCYTIC ANEMIA IN DOMESTIC
ANIMALS
ETIOLOGIA E DIAGNÓSTICO LABORATORIAL
Polliana Alves Franco, M.V. M.S.c.
Ciência Animal - UFMS
VetAnalisa
– Laboratório Veterinário
Rua
Professor Severino Ramos de Queirós, 226.
Vila
Glória. Campo Grande – MS
A anemia é um
distúrbio hematológico caracterizado pela redução simultânea dos valores de
volume globular (VG), número de eritrócitos circulantes e teor de hemoglobina.
As principais causas estão correlacionadas com processos hemolíticos, perda
sanguínea e hipo ou aplasia medular. De maneira didática são classificadas em
microcíticas, normocíticas e macrocíticas, essa determinação vem da avaliação do Volume Corpuscular Médio (VCM) que tem relação direta com o
tamanho das hemácias. A anemia de pacientes que apresentam valores de VCM
abaixo dos observados para a referência da espécie são denominadas como do tipo microcítica, ou
seja, as hemácias apresentam tamanho
médio reduzido.
A
teoria para que as hemácias produzidas pela medula óssea tornem-se menores é
justificada pelo fato de que elas tem que carrear certo nível de hemoglobina no
seu interior. No momento que a produção da molécula de hemoglobina é
ineficiente há a indução de mitoses adicionais mantendo os níveis de
hemoglobina de uma hemácia normocítica em um corpúsculo de menor tamanho. A princípio esse mecanismo funciona porém com
a progressão da doença observa-se que a Concentração de Hemoglobina Corpuscular
Média (CHCM) tende a reduzir alterando a classificação a anemia
microcítica normocrômica inicial
para uma anemia microcítica
hipocrômica.
Figura
1 – Esfregaço sanguíneo de cão apresentando microcitose e hipocromia. Coloração
de Panótico. Objetiva 100x.
As causas
primárias (TABELA 1) deste tipo específico de anemia são: a deficiência de
ferro (Fe 2+), seja ela por deficiência nutricional, distrúrbio
metabólico ou perda sanguínea. O
conhecimento das causas primárias permite gerar uma série de diagnósticos
diferenciais que podem afetar os animais tais como as endoparasitoses,
hemorragias crônicas, coagulopatias, anemia da inflamação, neoplasias e deficiências
nutricionais.
A deficiência
de ferro nutricional é inicialmente normocrômica e a medida que os estoques de
ferro corpóreo vão reduzindo as hemácias microcíticas consequentemente serão
produzidas. Como o leite contém pouco ferro os animais recém nascidos em fase
de crescimento são mais predispostos a desenvolver anemia secundária a
deficiência do mineral.
A anemia
causada pela perda crônica de sangue é ocasionada pela deficiência do Fe 2+.
O Ferro não é o único componente perdido capaz de influenciar no processo de
anemia, porém é o que detém papel
principal. A perda sanguínea para o meio externo de modo crônico pode ocorrer
tanto pelo trato gastrointestinal como pelo trato urinário. A reticulocitose
pode estar presente até que haja depleção dos estoques de ferro.
A patogenia da
anemia causada pela Doença Inflamatória Crônica (DIA) envolve mecanismos que
alteram a sobrevida dos eritrócitos (elevação de IL-1 e lesões oxidativas), a
diminuição da mobilização do Fe 2+ e hipoplasia da série eritrocitária.
A sua ocorrência é comum nos mamíferos uma vez que está associada a doenças
como neoplasias malignas, processos inflamatórios crônicos, infecções
bacterianas, fúngicas e por protozoários, geralmente é normocítica
normocrômica, mas pode progredir para a microcitose.
A anemia
causada pela deficiência de Cobre em suínos e cães está relacionada ao
transporte do Ferro. Quando há deficiência de Cobre existe menor atividade da
oxidase férrica que diminui a absorção intestinal e diminui a liberação do
ferro para fora dos macrófagos o que consequentemente o torna indisponível
levando a síntese defeituosa da Hemoglobina.
O mecanismo
causador da anemia em animais com Shunts portossistêmicos não foram totalmente
esclarecidos, acredita-se que ocorra deficiência funcional do Fe 2+
decorrente do prejuízo na síntese de moléculas carreadoras secundária ao dano
hepático.
A Diseritropoese em cães da raça English
Springer Spaniel é um distúrbio familiar de patogenia desconhecida que causa
polimiopatia, megaesôfago, cardiopatia e anemia microcítica não regenerativa. A
avaliação sanguínea desses animais revela rubricitose, esferocitose,
codocitose, dacriocitose, esquizocitose e eritrócitos vacuolizados.
Os
achados laboratoriais observados no esfregaço sanguíneo incluem alterações morfológicas nas hemácias, além da
microcitose, pois elas são mais propensas a danos estruturais. Ainda podem ser
encontrados leptocitose, codocitose, hipocromia, anisocitose, poliquilócitose,
hemácias fragmentadas (esquistócitos) e em alguns casos trombocitose.
A terapêutica nesses
casos deve levar em consideração o diagnóstico etiológico primário, posto que a
simples reposição do ferro perdido pode não ser suficiente para cessar o
mecanismo pelo qual a anemia foi gerada. A transfusão sanguínea pode ser
utilizada como medida a ser tomada em casos de urgência, porém os clínicos
veterinários devem ter em mente que a anemia não é a causa e sim uma
anormalidade secundária provocada por um distúrbio crônico importante que pode
em alguns casos ter prognóstico desfavorável.
Tabela 1 – Principais causas de anemia
microcítica normocrômica ou hipocrômica em animais domésticos.
|
·
Deficiência de ferro (semanas a meses)
|
· Hemorragia externa crônica (úlceras gastrointestinal e hematúria)
|
·
Deficiência de Cobre
|
·
Deficiência de vitamina B6 – piridoxona
|
·
Shunts porto sistêmico
|
·
Doença Inflamatória Crônica
|
·
Insuficiência hepática
|
·
Envenenamento por Molibdênio
|
· Diseritropoese em cães da raça English Springer Spaniel
|
MICROCITOSE EM ANIMAIS NÃO ANÊMICOS
· · ·
Alguns cães da raça Akita e Shiba
tem valores de VCM mais baixos que a referência estabelecida para a espécie
canina que variando em torno de 50 a 60 fL. Outros cães de origem japonesa como
Jindo, Chow chow e Sharpei podem apresentar hemácias com valores de volume
médios inferiores aos valores de normalidade. Potros e filhotes de gatos
possuem valores de VCM menores quando comparados aos animais de idade adulta.
Referência Bibliográfica
FLEISCHMAN,
W. Anemia: Determining the Cause. Compendium: Continuing Education for
Veterinarians. p. E1- E9. 2012.
GARCIA, C. Z., HERRERA, M. de S., JÚNIOR, J. M. F., ALMEIDA,
M. F., RAMOS, M. H. F., SACCO, S. R. Anemia microcítica em pequenos animais. Revista Científica Eletrônica de Medicina
Veterinária. Ano VI, n. 11. 2008.
HARVEY, J.W. Microcytic Anemias. In: FELDMAN, B.F.; ZINKL, J.G.; JAIN, N.C. Schalm’s
Veterinary Hematology. 5.ed. Philadelphia: Lippincott
Williams&Wilkins, p.200-204, 2000.
MEYER, D. J. , COLES, E. H., RICH, L. J. Medicina de Laboratório Veterinária.
Primeira edição. São Paulo: Roca, p. 11 – 23. 1995.
SOETAN, K. O., OLAIYA, C. O., OYEWOLE, O. E.
The importance of mineral elements for humans, domestic animals and plants: A
review. African Journal of Food
Science. Vol. 4(5) p. 200-222, 2010.
STOCKHAM, S. L. & SCOTT, M.
A. Fundamentos de Patologia Clínica
Veterinária. Rio de Janeiro: Guanabara Koogan. 2 ed. p. 90-186. 2008.